|
MODULO FUNDAMENTOS DE REFRIGERACION |
ING ANTONIO FAVIO OSPINO MARTINEZ
CANAL YOUTUBE: ANTONIO OSPINO
TABLA DE CONTENIDO DEL MODULO
Tabla de contenido
del capítulo
1. GENERALIDADES DE LA REFRIGERACION
1.1. APLICACIONES DE LA REFRIGERACION
1.1.1. REFRIGERACION DOMESTICA
1.1.2. REFRIGERACION COMERCIAL
1.1.3. REFRIGERACIÓN INDUSTRIAL
1.1.5. ACONDICIONAMIENTO DE AIRE
1.2. SISTEMAS DE REFRIGERACION
1.4. COMPORTAMIENTO DE LA MATERIA
1.5. ESTANDARES DE MASA, TIEMPO,
LONGITUD, VELOCIDAD, ACELERACION, FUERZA, ENERGIA, POTENCIA, CALOR.
1.5.13.1. CALOR ESPECÍFICO ( Ce )
1.5.13.2. CALOR ESPECIFICO A
PRESION CONSTANTE ( CP )
1.5.13.3. CALOR ESPECIFICO A
VOLUMEN CONSTANTE ( CV )
1.5.14. METODOS DE TRANSFERENCIA DE CALOR
1.5.14.4. ANALOGIA ENTRE CONDUCCIÓN DE
CALOR, CONDUCCIÓN ELECTRICA Y SISTEMAS HIDRAULICOS.
1.5.17. FLUJO DE CALOR O POTENCIA
CALORIFICA (
1.6.2. VOLUMEN ESPECIFICO ( vS
):
1.6.3. CAUDAL O FLUJO VOLUMETRICO
( QVOL )
1.6.6. FLUJO DE MASA O MASICO (
1.6.7. ECUACION DE ESTADO DE LOS GASES Y
LEYES DE LOS GASES.
1.7. EL ASUNTO DE LA REFRIGERACION
1.8. DIAGRAMAS PRESION – ENTALPIA Y
TEMPERATURA – ENTROPIA
1.8.1. ORIGENES DE LOS DIAGRAMAS
DE MOLLIER
1.8.2. GENERALIDADES DEL PUNTO TRIPLE.
1.8.3. DIAGRAMA TEMPERATURA Vs
ENTROPIA ESPECIFICA
1.8.4. DIAGRAMA PRESION Vs
ENTALPIA ESPECIFICA
1.8.5. EL CONCEPTO DE LA TEMPERATURA DE
SATURACION
1.9. FUNDAMENTOS DE LA MECANICA DE
FLUIDOS APLICADOS A REFRIGERACION Y CLIMATIZACION
1.9.1. ECUACION DE CONTINUIDAD DE FLUJO
1.
GENERALIDADES
DE LA REFRIGERACION
El concepto de refrigeración tiene que ver
con la disminución de la temperatura de un cuerpo o una sustancia. Otros
conceptos tienen que ver no solo con la reducción sino con el mantenimiento de
esa temperatura por debajo de la del ambiente o entorno.
La aplicación de los procesos de
refrigeración es tan antigua como el hombre mismo, con el fin de conservar los
alimentos principalmente. Uno de los primeros “refrigeradores” primitivos fue
el permafrost o barro congelado; este método los hacían los primitivos hombres
haciendo huecos en la tierra, donde ubicaban los alimentos para después
taparlos con el mismo barro o una combinación de barro con piedras,
constituyéndose en el primer “ refrigerador “ hecho por el ser humano.
Otro elemento empleado en
refrigeración es el hielo, dicho refrigerante estaba muy extendido hasta poco
antes de la I Guerra Mundial, cuando aparecieron los refrigeradores mecánicos y
eléctricos. La eficacia del hielo como refrigerante es debida a que tiene una
temperatura de fusión de 0 °C y para fundirse tiene que absorber una cantidad
de calor equivalente a 333,1 kJ/kg. La presencia de una sal en el hielo reduce
en varios grados el punto de fusión del mismo. Los alimentos que se mantienen a
esta temperatura o ligeramente por encima de ella pueden conservarse durante
más tiempo.
El dióxido de carbono sólido, conocido como hielo seco o nieve carbónica,
también se usa como refrigerante. A la presión atmosférica normal no tiene fase
líquida, y sublima directamente de la fase sólida a la gaseosa a una
temperatura de -78,5°C. La nieve carbónica es eficaz para conservar productos a
bajas temperaturas mientras dura su sublimación.
En la refrigeración mecánica se obtiene un enfriamiento constante mediante la
circulación de un refrigerante en un circuito cerrado, donde se evapora y se
vuelve a condensar en un ciclo continuo. Si no existen pérdidas, el
refrigerante sirve para toda la vida útil del sistema. Todo lo que se necesita
para mantener el enfriamiento es un suministro continuo de energía y un método
para disipar el calor. Los dos tipos principales de sistemas mecánicos de
refrigeración son el sistema de compresión, empleado en los refrigeradores
domésticos grandes y en la mayoría de los aparatos de aire acondicionado, y el
sistema de absorción, que en la actualidad se usa sobre todo en los
acondicionadores de aire por calor, aunque en el pasado también se empleaba en
refrigeradores domésticos por calor.
1.1.
APLICACIONES DE LA
REFRIGERACION
Ahora hay numerosas aplicaciones para los
procesos de refrigeración: Como ejemplos tenemos:
·
Conservación de
productos alimenticios.
·
Transporte de alimentos
·
Conservación de productos farmacéuticos.
·
Acondicionamiento de aire
·
Plantas secadoras
·
Instalación de enfriamiento de agua
·
Contenedores
refrigerados.
·
Procesos industriales.
·
Bombas de calor
·
Fábricas de hielo
·
Liofilización.
De hecho, es difícil
imaginar la vida sin refrigeración y congelación, este impacto en nuestra
existencia es mucho más grande que lo que la gente se imagina. Las
aplicaciones en refrigeración se han agrupado en seis grandes categorías
generales
1.1.1.
REFRIGERACION
DOMESTICA
Este campo está limitado principalmente a
refrigeradores y congeladores caseros. Sin embargo, debido a que es muy grande
el número de unidades en servicio, la refrigeración doméstica representa una
parte significativa de la refrigeración en general.
Las unidades domésticas son de tamaño
pequeño teniéndose capacidades de potencia que fluctúan entre 1/20 y ½ HP y los
compresores son de sellado hermético.
1.1.2.
REFRIGERACION
COMERCIAL
Se refiere al diseño, instalación y
mantenimiento de unidades de refrigeración del tipo que se tienen en
establecimientos comerciales para su venta al menudeo, restaurantes, hoteles e
instituciones que se dedican al almacenamiento, exhibición, procesamiento y a
la distribución de artículos de comercio. Las capacidades de los compresores
pueden variar de los ½ HP hasta los 5 HP. Los cuales pueden ser herméticos o
semiherméticos.
1.1.3.
REFRIGERACIÓN
INDUSTRIAL
A menudo se confunde con la refrigeración
comercial porque su división no está claramente definida. Como regla general,
las aplicaciones industriales son mas grandes en tamaño que las aplicaciones
comerciales y, la característica que las distingue es que requieren un empleado
para su servicio. Algunas aplicaciones industriales típicas son plantas de
hielo, grandes empacadoras de alimento, cervecerías, lecherías, etc. Las
capacidades de los compresores son, por lo general de 5 HP en adelante,
pudiendo ser semiherméticos o abiertos.
1.1.4.
TRANSPORTE
REFRIGERADO
Se refiere a la refrigeración que se tiene
camiones, barcos de tipo pesquero, y barcos de transporte de alimentos, trenes,
etc. La refrigeración de transporte se refiere al equipo de refrigeración
utilizado en camiones, conteiner, etc.
1.1.5.
ACONDICIONAMIENTO
DE AIRE
Concierne o se refiere a la condición del
aire en algún área o espacio designado. Por lo general involucra no únicamente
el control de la temperatura del espacio, sino también de las condiciones de
humedad del mismo, filtrado y limpieza.
Las aplicaciones de acondicionamiento de
aire son de dos tipos : las aplicaciones estacionarias y las móviles. Entre las
aplicaciones estacionarias se tiene los siguientes equipos:
Entre las aplicaciones móviles, se tienen:
1.2.
SISTEMAS
DE REFRIGERACION
Se puede efectuar la refrigeración por
comprensión de vapor, por absorción y termoelectricidad.
El sistema de refrigeración que más se emplea es el de comprensión. En las
máquinas de este tipo constituye la parte central del sistema la bomba o
compresor, que recibe vapor a baja presión y lo comprime. Con esta operación se
elevan considerablemente la presión y la temperatura del vapor. Luego, este
vapor comprimido y calentado fluye por el tubo de salida hasta el condensador
térmico, donde el vapor cede su calor al agua o aire frío que rodea al
condensador. En esta forma su temperatura desciende hasta el punto de
condensación, y se convierte en líquido con la correspondiente liberación de
calor que ocurre en estos casos.
El agente frigorífico, en estado líquido, pasa del condensador hasta un
receptáculo y de allí fluye por un conducto o válvula, o el tubo reductor,
disminuye la presión del líquido a medida que fluye dentro del vaporizador para
enfriarlo. Este vaporizador se haya en el espacio que desea refrigerar. El aire
tibio de este recinto le transmite, por contacto, al vaporizador parte de su
calor, y hace que el líquido se evapore. Como se ve este nuevo cambio de
estado, de líquido a vapor, se efectúa aumentando la temperatura. A
continuación, aspira el compresor, por el tubo de succión, el vapor caliente
del evaporador, y, después de volverlo a comprimir, lo impulsa al condensador,
como se explicó anteriormente. Se repite así el proceso en ciclos continuos. En
las grandes instalaciones refrigeradoras se utiliza generalmente amoníaco como
agente frigorífico, mientras que en los refrigeradores domésticos se emplea
anhídrido sulfuroso, cloruro de metilo y freón. Desde que se comenzó a
refrigerar mediante sistemas mecánicos se ha aumentado constantemente el número
de agentes frigoríficos, lo cual se debe a las investigaciones efectuadas por
los químicos en su afán de hallar nuevas sustancias con características
apropiadas para responder a las necesidades planteadas por los nuevos usos y
tipos de instalaciones. Los refrigerantes sintéticos conocidos con el nombre de
freones, constituyen un buen ejemplo del resultado alcanzado gracias a las
investigaciones científicas.
En el sistema de absorción se consigue el enfriamiento mediante la energía
térmica de una llama de gas, de resistencias eléctricas, o de la condensación
del vapor de agua a baja presión. La instalación tiene una serie de tubos de
diversos diámetros, dispuestos en circuito cerrado, los cuales están llenos de
amoniaco y agua. El amoniaco gaseoso que hay en la instalación se disuelve
fácilmente en el agua, formando una fuerte solución de amoniaco. Al calentarse
ésta en la llama de gas, o por otro medio, se consigue que el amoniaco se
desprenda en forma de gas caliente, lo cual aumenta la presión cuando este gas
se enfría en el condensador, bajo la acción de agua o aire frío, se produce la
condensación y se convierte en amoniaco líquido. Fluye así por una válvula
dentro de evaporador, donde enfría el aire circundante absorbiendo el calor de
éste, lo cual produce nuevamente su evaporación. A continuación, entra el
amoniaco, en estado gaseoso, en contacto con el agua, en la cual se disuelve.
Esta fuerte solución de amoníaco retorna, impulsada por la bomba, al
gasificador o hervidor, donde la llama de gas se calienta, entonces vuelve a repetirse el ciclo.
Tanto el sistema de enfriamiento por absorción como el de compresión, están
basados en los cambios de estado del agente frigorífico. Ambos sistemas tienen
condensador, vaporizador y el medio adecuado para crear la presión necesaria
que motive la condensación, tal como un compresor o una fuente que produzca
calor.
El sistema de termoelectricidad consiste en
placas semicondutoras que al aplicarles un voltaje de tipo directo, en un lado
de la placa se torne caliente y el otro lado frío, este mecanismo aun es muy
ineficiente pero con el paso del tiempo se esta empleando en pequeños bebederos
y neveras para vehículos.
1.3.
ESTADOS
DE LA MATERIA
Toda
materia conocida, existe de las tres formas físicas estados: Sólida, líquida o
gaseosa. Hay marcada diferencia entre estos estados físicos, a saber. Cambios
de Estado de la materia. En la siguiente tabla se presentan algunas
características físicas de dichos estados.
|
Estado |
Sólido |
Líquido |
Gas |
|
Volumen |
Definido |
Definido |
Indefinido |
|
Forma |
Definida |
Indefinida |
Indefinida |
|
Compresibilidad |
Incompresible |
Incompresible |
Compresible |
|
Atracción entre Moléculas |
Intensa |
Moderada |
Despreciable |
1.3.1.
ESTADO
SÓLIDO
En el Estado Sólido, las Moléculas ocupan posiciones fijas dentro de una Red Cristalina y su movimiento se reduce a vibraciones. Las moléculas, átomos o iones que componen la sustancia considerada están unidas entre sí por fuerzas relativamente intensas, formando un todo compacto.
.
La mayor proximidad entre sus partículas constituyentes es
una característica de los sólidos y permite que entren en juego las fuerzas de
enlace que ordenan el conjunto, dando lugar a una red cristalina. En ella las
partículas ocupan posiciones definidas y sus movimientos se limitan a
vibraciones en torno a los vértices de la red en donde se hallan situadas. Por
esta razón las sustancias sólidas poseen forma y volumen propios.
1.3.2.
ESTADO
LÍQUIDO
En el Estado líquido el movimiento de las Moléculas se halla
restringido. A nivel microscópico se caracteriza porque la distancia entre las
moléculas es sensiblemente inferior a la de los gases. Mientras que en un gas
la distancia intermolecular media es igual o mayor que diez veces el tamaño de
la molécula, en un líquido viene a ser del mismo orden de magnitud que el
diámetro molecular, y sólo un poco mayor que en los sólidos. Eso explica que la
densidad de los líquidos sea, salvo algunas excepciones, sólo algo inferior a
la de los sólidos.
La proximidad entre las moléculas hace que se dejen sentir
fuerzas atractivas de interacción, que evitan que una molécula pueda
"escaparse" de la influencia del resto, como sucede en el estado
gaseoso, pero que les permite moverse deslizándose unas sobre otras. Por esta
razón los líquidos no poseen forma propia, sino que se adaptan a la del
recipiente que los contiene, es decir, pueden fluir. Sin embargo, el hecho de
que las moléculas estén ya suficientemente próximas hace de los líquidos fluidos
incompresibles. Toda compresión lleva consigo una disminución de la distancia
intermolecular, y si ésta fuera apreciable entrarían en juego las fuerzas
repulsivas entre los núcleos atómicos que se opondrían a dicha compresión y la
neutralizarían.
1.3.3.
ESTADO
GASEOSO
En el estado gaseoso las moléculas están muy separadas en el
espacio. El Volumen real de las moléculas individuales es despreciable en
comparación con el volumen total del Gas como un todo. Ejemplo Si un cilindro
de un pie cúbico, que contiene vapor de agua o cualquier otro gas, se conecta a
un cilindro de 2 pies cúbicos, el vapor se expandirá para ocupar el volumen del
cilindro mayor. Los gases poseen las siguientes propiedades:
·
Las fuerzas de atracción entre las moléculas son débiles o
despreciables.
·
Las moléculas poseen mucha libertad de movimiento.
·
Las moléculas del gas tienden a ocupar todo el espacio del
recipiente que los contenga.
·
Los gases se pueden comprimir y descomprimir.
1.3.4.
ESTADO
PLASMA
Cuando
se aplica grandes cantidades de calor, el gas comienza a estar un estado de gas
supercalentado, en ese momento, los electrones de la periferia de los átomos
del gas, comienzan a desprenderse de los mismos, convirtiéndose en átomos
cargados eléctricamente o iones, por eso a este nuevo estado se le denomina gas
ionizante, adquiriendo propiedades eléctricas.
1.4.
COMPORTAMIENTO
DE LA MATERIA
Se
conocen entonces varios cambios de estado de la materia y todos ellos ocurren
por la absorción o eliminación de calor a temperatura constante.
·
SOLIDIFICACION:
Pasa de líquido a sólido.
·
FUSION
O LICUEFACCION: Pasa de Sólido a líquido.
· VAPORIZACION O EVAPORACION: pasa de líquido a vapor.
·
CONDENSACION:
Pasa de vapor a líquido.
·
SUBLIMACION:
Pasa de Sólido a vapor sin pasar por el estado líquido.
· SUBLIMACION INVERSA: Pasa de vapor a sólido sin pasar por el estado líquido.
Todos los cambios de estado tienen las siguientes características:
·
Ocurren
a temperatura constante.
·
Suceden
debido a la absorción o retiro de grandes cantidades de calor.
1.1.
ESTANDARES
DE MASA, TIEMPO, LONGITUD, VELOCIDAD, ACELERACION, FUERZA, ENERGIA, POTENCIA,
CALOR.
1.5.1.
MASA ( m )
Es
la cantidad de materia que poseen los cuerpos. Sus unidades son el gramo, Kilogramo
masa ( SI ), Slug o libra masa ( S ingles ).
Conversiones:
|
1 Slug =
14.59 Kg |
1 Lbm =
453,59 grm |
1 kgm = 2,205
Lbm |
1.5.2.
TIEMPO ( t )
Se
mide en segundos, minutos, horas.
1.5.3.
LONGITUD ( L )
Para
medir distancias; en el sistema internacional ( SI ) la unidad de medida es el Metro;
en el sistema de medición ingles el Pie ( FeeT ) o Pulgadas ( inches ).
Conversiones:
|
1 Ft = 0.3048
Mts |
1 in = 2.54
cms |
1 Yarda = 3
Ft |
|
1 Milla =
5280 Ft |
1 Milla =
1,61 Kms |
|
1.5.4.
SUPERFICIE ( A )
Se
refiere a un porción, contorno o capa que delimita a un cuerpo. Sus unidades
comunes son de longitud cuadradas como metros cuadrados, pulgadas cuadradas,
etc
1.5.5.
VOLUMEN ( VOL )
Es
el espacio que ocupa un cuerpo. Se mide en unidades de longitud cúbicas.
Conversiones:
|
1 Litro =
1000 cms3 |
1 Litro =
0,0353 Ft3 |
1 Litro =
0,2642 Galones |
|
1 Litro =
61,025 in3 |
1 Litro = 10-3
Mts3 |
|
1.5.6.
VELOCIDAD ( V )
Es
la distancia que se recorre en un tiempo determinado. Sus unidades están en
función de unidades de longitud entre unidades de tiempo.
1.5.7.
ACELERACIÓN ( a )
Es
el cambio de la velocidad en el tiempo, sus unidades son Metros/Seg 2,
pies/seg2 . Su fórmula es:
a = Velocidad
Final – Velocidad Inicial
Tiempo
1.5.8.
GRAVEDAD ( g )
Es
la aceleración que experimentan los cuerpos al caer, su valor a nivel del mar
es deM9.8 Mts/ Seg2 . La gravedad varia con la altura sobre el nivel
del mar, a mayor altitud, menor es la gravedad. En el espacio, la gravedad es
CERO, por esta razón los cuerpos no caen y flotan.
1.5.9.
FUERZA ( F )
Es
toda acción que puede causar una deformación, desplazamiento o modificar el
estado de movimiento de un cuerpo. Su fórmula es:
Fuerza = Masa *
Aceleracion
Conversiones:
|
1 Lbf = 4.448
N |
1 Kgf = 9.8 N |
1 N = 105
Dinas |
|
1 Tonelada =
2000 Lb |
|
|
1.5.10.
PESO
Es
la atracción que experimenta la masa al efecto de la gravedad. Su fórmula es:
Peso = Masa *
Gravedad
Posee
las mismas unidades de fuerza.
1.5.11.
ENERGIA ( E )
La energía es la capacidad de los cuerpos
para realizar un trabajo y producir cambios en ellos mismos o en otros cuerpos.
Es decir, el concepto de energía se define como la capacidad de hacer funcionar
las cosas.
Debido
a su variada naturaleza, se puede encontrar energía mecánica ( trabajo ),
energía eléctrica, energía calorífica, energía química, energía lumínica, etc.
Sus
unidades comunes son Joules, Calorias, BTU, Ergios, FtLb
1.5.12.
TRABAJO ( W )
Medida de la transferencia de energía de
tipo mecánica que se produce cuando un objeto es movido cierta distancia por la
acción
de una fuerza. Se considera un tipo de energía mecánica.
Trabajo ( W ) =
Fuerza * Distancia recorrida = F * d
Sus
unidades comunes son: Jouls ( N*mts ); Lbf Ft ; Kgf Mts
Conversiones:
|
1 Kgf Mts = 9.8 J |
1 Ft Lb = 1.356 J |
1 Joul = 107 Ergios |
Hay
otros tipos de energías térmicas que son medidas en BTU y Calorías, las cuales
tienen que ver con la variación de la temperatura de una sustancia, cuando
adicionamos o retiramos calor de una sustancia.
1.5.13.
CALOR ( Q )
El calor es energía de tipo térmica, en
tránsito debido a la diferencia de temperaturas entre dos cuerpos, la cual
puede ya sea variar la temperatura de las sustancias o cambiar su estado.
La unidad de calor que se emplea
comúnmente es la CALORIA, definida como la cantidad de calor necesaria para
variar la temperatura de 1 gramo de agua desde 14,5 ºC hasta 15.5 ºC. La unidad
de calor en el sistema ingles es el BTU ( BRITISH THERMAL UNIT ) y se define
como el calor requerido para variar la temperatura de 1 libra masa de agua
desde 63 ºF hasta 64 ºF.
|
|
|
Las
unidades comunes de calor son:
|
1 Caloria =
4,1868 J |
1 BTU =
778,16 Ft Lbf |
1 BTU =
1055,07 J |
|
1 BTU = 0,252
KCalorias |
1 Kwatt Hr =
3413 BTU |
1 Kcal =
1,1626 Watt Hr |
El aumento o disminución de temperatura de
una sustancia depende en gran medida de la cantidad de calor añadido o retirado
de la misma, o sea, a mayor calor añadido mayor temperatura y viceversa;
también depende de la masa de la sustancia, o sea, a mayor masa menor será el
incremento o decremento de temperatura. Pude decirse entonces que:
DT è ( 1 / m ) y DT è ( Q ) por lo tanto se puede decir
que DT è ( Q / m )
Si
se despeja Q se tiene que: Q = DT * m
Ver
video:
CONCEPTO DE CALOR COMO FORMA DE ENERGIA
1.5.13.1.
CALOR ESPECÍFICO ( Ce )
Es el calor que tiene una sustancia por
unidad de masa, en otras palabras, es la cantidad de calor que se requiere,
para que la unidad de masa de un cuerpo o sustancia varie su temperatura ya sea
en 1 ºF o 1ºC. Sus unidades comunes son:
KJ/Kg
ºK o BTU/Lbm ºF
El calor especifico varia de sustancia a
sustancia y depende si se hace a presión constante o volumen constante.
1.5.13.2.
CALOR ESPECIFICO A PRESION CONSTANTE ( CP )
Es el número de unidades de calor
agregados por unidad de masa para aumentar la temperatura en un grado cuando la
presión se mantiene constante. Es el mas común en los cálculos de calor.
1.5.13.3.
CALOR ESPECIFICO A VOLUMEN CONSTANTE ( CV )
Es el numero de unidades de calor
agregados por unidad de masa para aumentar la temperatura de un fluido en un
grado cuando se mantiene constante el volumen.
Ambos calores específicos varían
ligeramente con la temperatura en que se trabaje. Las unidades de ambos son:
BTU / Lbm ºR; JOUL/Kg º K
Conversiones
1 kJ/ ( Kg ºK ) = 0,2389 BTU/( Lbm ºF )
|
SUSTANCIA |
CP PROMEDIO EN
BTU/Lbm ºF |
CP PROMEDIO en
KJ/Kgm ºK |
|
AGUA |
1,0072 *
10-5 |
4,20 |
|
AMONIACO |
1,09 * 10-5 |
4,7 |
|
PLACA DE
VIDRIO |
0,2 |
0,8 |
|
ASBESTO |
0,195 |
0,816 |
1.5.13.4.
CALOR SENSIBLE
Es aquel calor que varia la temperatura de
un cuerpo o sustancia sin cambiar el estado del mismo.
Por lo visto hasta el momento, si una
sustancia se le transfiera calor a presión constante, esta variación de
temperatura depende en parte de la cantidad de masa de la sustancia y de las
características de la misma, se puede concluir entonces que:
Q = m * Cp * DT
Q = m * Cp * ( TFINAL
– TINICIAL )
De lo anterior se deduce que si el calor
nos da un valor positivo, implica que la temperatura final de la sustancia es
mayor que la temperatura inicial de la misma, por tanto se le ha agregado
calor. Si el calor nos da un valor negativo, implica que la temperatura final
es menor que la inicial, por tanto se ha retirado calor de la sustancia.
Para efectos de cálculo se emplea muchas
veces el concepto de calor especifico, que no es nada más que el calor por
unidad de masa y sus unidades comunes son BTU/Lbm y Kcal / grm
q = Q/m è q = [ m * Cp * ( TFINAL
– TINICIAL ) ] / m
q = Cp * DT = Cp * ( TFINAL – TINICIAL
)
1.5.13.5.
CALOR LATENTE
Es
aquel calor que varía o cambia el estado de una sustancia manteniendo contante
su temperatura durante todo el proceso.
La
fórmula del calor sensible no es aplicable ya que en el calor latente, se
mantiene constante la temperatura y por tanto el DT
se hace cero ( 0 ). En el calor latente hay un cambio de fase de la sustancia
por tanto:
|
Q = m * L Q = ( HFINAL – HINICIAL ) |
m: Masa de la sustancia L: Calor latente a una presión dada H: Entalpia de la sustancia a una presión y temperatura dada |
Para efectos de cálculo se emplea también a veces el concepto de calor especifico, que no es nada más que el calor por
unidad de masa y sus unidades comunes son BTU/Lbm y Kcal / grm
q = Q/m è q = ( HFINAL – HINICIAL
) / m
q = ( hFINAL – hINICIAL
), donde h es la entalpia especifica h = H/m
Ver
video:
CONCEPTO DE CALOR COMO FORMA DE ENERGIA
1.5.14.
METODOS
DE TRANSFERENCIA DE CALOR
Se había dicho que el calor es la energía
en transito que ocurre cuando hay una diferencia de temperatura entre dos o mas
sustancias o cuerpos. El calor se transmite desde la sustancia con mayor
temperatura hasta la de menor temperatura hasta que exista un equilibrio
térmico. El calor se trasmite por varios medios entre los que están:
1.5.14.1.
CONDUCCION
La
conducción se define como el flujo calor entre cuerpos sólidos en contacto. Los
primeros adelantos relacionados con la conducción de calor , se deben, en gran
parte, a los estudios del matemático francés Fourier, que propuso la ley que
lleva su nombre.
1.5.14.2.
CONVECCION
Se refiere al flujo de calor entre una
superficie y un fluido en contacto con dicha superficie, en la medida que
exista una diferencia de temperatura entre las mismas. Por ejemplo, considere
una pared caliente vertical y en contacto con un fluido muy frío. Con el
transcurso del tiempo, el fluido en contacto inmediato con la pared se calienta
por conducción, provocando que el fluido se haga menos denso. Debido a la
diferencia de densidades, se obtiene una fuerza de flotación resultante,
provocando que el fluido más ligero se eleve y lo reemplace otra cantidad de
fluido más frío, repitiéndose continuamente este proceso. Puesto que el
movimiento de fluido queda establecido por fuerzas naturales, a este tipo de
convección se le llama LIBRE o NATURAL. Si en la pared del ejemplo mencionado
se colocara a funcionar un ventilador, entonces la fuente externa ( el
ventilador ) provocaría el movimiento del fluido, dando como resultado una
convección FORZADA. En la práctica, se emplea la siguiente expresión para determinar
razones de transferencia de calor por convección:
1.5.14.3.
RADIACIÓN
En la radiación, no se requiere que exista
un fluido para que las superficies intercambien calor. Los líquidos, sólidos y
algunos gases emiten radiación térmica como resultado de sus temperaturas. Un
emisor ideal, que se llama CUERPO NEGRO, emite radiación térmica de acuerdo a
la ecuación de Stefan – Boltzman:
Como conclusión general de analizar los
tres procesos se pude analizar que:
·
La
transferencia de calor es directamente proporcional a la diferencia de calor
entre los elementos involucrados.
·
El
tipo de material por el cual se trasmite el calor influye en la cantidad del
mismo.
·
El
área transversal al flujo de calor es directamente proporcional al flujo del
mismo.
1.5.14.4.
ANALOGIA
ENTRE CONDUCCIÓN DE CALOR, CONDUCCIÓN ELECTRICA Y SISTEMAS HIDRAULICOS.
Si un resistor eléctrico que tiene un
valor de resistencia constante R, tiene una diferencia de voltaje V, que se
imprime a través de él, se sabe por experiencia que fluirá una corriente
eléctrica I, a través del dicho resistor. La magnitud de la corriente varia
linealmente con la magnitud de la diferencia de voltaje impresa a través del
resistor. Una situación análoga se encuentra en el caso del flujo de agua que
emana de un grifo a baja velocidad. Extendiendo esta analogía al caso de flujo
de calor a través de una pared, es posible encontrar las siguientes
comparaciones:
·
La
diferencia de temperatura a través de la pared representa la diferencia de
potencial o la fuerza de empuje.
·
Q
representa al flujo de corriente I.
·
(
L / K A ) que aparece en la ecuación de Q, representa la resistencia térmica al
flujo de3 calor por conducción.
En
conclusión:
|
V = I *
R análogamente ( T2 – T1
) = Q ( L / KA )
|
Donde : V @ ( T2 – T1 ) I @ Q R @ ( L / KA ) |
1.5.15.
TEMPERATURA ( T )
Es la medida de la cantidad de energía
calorífica de un cuerpo. Las medidas comunes de temperatura son Grado
centígrado ( ºC ) el Grado Fahrenheit ( º F ), el Grado Kelvin ( ºK ) y el
grado Ranking ( ºR ).
Conversiones:
|
º K = ºC +
273,15 |
º F = 1.8 ºC
+ 32 |
ºR = ºF +
459,67 |
ºR = 1,8 ºK |
1.5.16.
POTENCIA ( P )
Es la rapidez con que se realiza un
trabajo, la eficiencia con que realiza un trabajo o la rapidez con que se
produce o consume energía.
Potencia ( P ) = Energía
/ tiempo = W/t
Sus
unidades comunes son:
Watt
( W ): Muy usado en sistemas de potencia eléctrica, pero también se usa mucho
en sistemas de potencias térmicas. El watt sale de la energía en Jouls
utilizada en 1 segundo.
Caballos fuerza ( Hp ): Muy usado en
sistemas de potencias de tipo mecánico. El HP ( Horse Power ) fue propuesto por James Watt para
expresar la potencia que podía desarrollar la novedosa máquina de vapor (en su
época), con respecto a la potencia que desarrollaban los caballos. Estos
animales eran las «máquinas» de trabajo que se usaban ampliamente para mover
molinos, levantar cargas, mover carruajes y muchas otras actividades. Tras
varios experimentos y aproximaciones de cómo medir y expresar la potencia de
los caballos, James Watt estimó que un caballo podía levantar 330 libras-fuerza
a una altura de 100 pies en un minuto.
Por tanto 1 HP = 33300 Lbf Ft / Min
BTU/Hr, Calorias/Hr: Son unidades de
potencias térmicas, muy usadas en refrigeración y climatización relacionadas
con la energía térmicas que se extrae o ingresa a una sustancia en el tiempo.
Las maquinas, para poder funcionar,
requieren el suministro de una potencia ( Potencia de Entrada o de Suministro
), la cual se convierte en otro tipo de potencia ( de salida o útil ) de
acuerdo a los requerimientos:
Conversiones:
|
1 Ft
Lb/Seg = 1.356 W |
1 BTU/Hr =
0,293 Watt |
1 HP = 550
Ft Lbf / Seg |
|
1 Hp =
2545 BTU/Hr |
1 Hp = 746
W |
1 Watt =
3,413 BTU/Hr |
|
1 Kw =
1000J/seg |
1 Kw =
1.35 Hp |
1 Kw =
3600 Kj/hr |
1.5.17.
FLUJO DE CALOR O POTENCIA CALORIFICA (
)
Es
el calor transmitido o transferido por unidad de tiempo.
Sus unidades comunes son: Cal/Hr ; BTU/Hr; Tonelada de refrigeración.
Esos
datos los podemos ver en la etiqueta del articulo:
OBS:
En el caso de extracción de calor a un cuerpo o sustancia se le denomina
Potencia Frigorífica.
Ver
video:
UNIDADES DE CALOR Y POTENCIA FRIGORIFICA EN SISTEMAS DE REFRIGERACION Y CLIMATIZACION
Conversiones:
|
1 BTU/HR =
0,293 WATT |
1 BTU/HR =
1.055 KJ/HR |
1 BTU/HR =
0.252 KCAL/HR |
1 BTU/HR =
778 FT LBF/HR |
|
1 KWATT =
3413 BTU/HR |
1 KWATT = 1.341
HP |
1 KWATT =
859.8 KCAL/HR |
1 KWATT =
3600.7 KJ/HR |
|
1 TR =
12000 BTU/HR |
1 TR =
3.516 KWATT |
1 TR = 4.715
HP |
1 TR = 12660
KJ/HR |
|
1 HP =
2545 BTU/HR |
1 HP =
0.7457 KWATT |
1 HP = 0.212
TR |
1 HP = 2685
KJ/HR |
1.6.
ALGUNAS
PROPIEDADES DE LAS SUSTANCIAS DE USO EN EL ANALISIS DE SISTEMAS DE REFRIGERACION
O CLIMATIZACION.
1.6.1.
DENSIDAD ( r )
Es la relación de la masa de una sustancia
entre el volumen que ocupa la misma sustancia, en otras palabras se refriere al
grado de compactación de la materia en una unidad de volumen. Sus unidades
comunes son Gramo/cms2 ; Lbm/ft3
r = ( Masa /
Volumen ) = m / VOL = 1 / VS
1.6.2. VOLUMEN ESPECIFICO ( vS ):
Es la relación entre el volumen que ocupa
la masa de una sustancia, o sea, el inverso de la densidad. Se puede deducir
también como el volumen que ocupa la
unidad de masa de la sustancia, o también como el espacio que ocupa una unidad
de masa. Es un concepto con el cual medimos indirectamente el tamaño de las
moléculas de las sustancias para el caso de los refrigerantes; a mayor densidad
de la sustancia, significa que el tamaño de las moléculas es pequeño y por
tanto se pueden “acomodar” más moléculas en el mismo espacio, haciendo que
exista, por consiguiente, mayor masa en ese espacio. Para el concepto del
volumen específico, al tener menor tamaño esa molécula, entones su masa ocupa
menos espacio y por consiguiente el valor del volumen específico es menor
vS = (
Volumen / Masa ) = VOL /m = 1
/ r
El volumen especifico y la densidad son
dos factores que hay que tener en cuenta en el rendimiento de los compresores:
Ver video:
CONCEPTOS DE DENSIDAD Y VOLUMEN ESPECIFICO Y SU INFLUENCIA EN RENDIMIENTO DE COMPRESORES
1.6.3.
CAUDAL O FLUJO VOLUMETRICO ( QVOL )
Es
la cantidad de volumen de un fluido por unidad de tiempo. Sus unidades son Lts/
seg; Mts3/Hr
QVOL =
( Volumen / tiempo ) = VOL / t = m
/ ( t * r ) = (
QVOL =
( Velocidad fluido * Area transversal del chorro fluido ) = V * A
1.6.4.
PESO ESPECIFICO ( g )
Es
la relación entre el peso de una sustancia y el volumen de la misma. Sus
unidades comunes son: N/Mts3 ; Lbf/Ft3 .
g = W / VOL = m g / VOL
= r * g
1.6.5.
PRESION
Es
la relación entre la fuerza normal que actúa sobre una superficie. Sus unidades
comunes son: Pa ( N / mts2 ); PSI ( Lbf / in2 ) ; Kgf/
cms2.
Conversiones:
|
1 Bar = 105
Pa |
1 Kgf /
Mts2 = 9.8 Pa |
1 Lb/in2
( PSI ) = 6895 Pa |
|
1 PSI =
6895*10-5 Bar |
14,22 PSI
= 1 Kgf/cms2 |
|
La presión ejercida por fluidos ( líquidos y gases ) se dan en todos los sentidos y direcciones con la misma intensidad.
Gracias
a esta propiedad, su usan fluidos hidráulicos para multiplicación de fuerzas:
1.6.5.1.
PRESION ATMOSFERICA
Es la presión ejercida por la masa de los
gases de la atmósfera normal a una superficie y medida con un instrumento que
se llama Barómetro; esta presión varía según la altitud sobre el nivel del mar,
a mayor altitud, menor presión atmosférica.
La presión atmosférica tiene un valor de:
|
1 atmósfera |
760 mm Hg |
14.7 Psi |
|
101325 Pa |
1,033 Kgf/cms2 |
101325*10 -5
Bar = 1,01325 Bar |
Gracias
a la presión ejercida por los gases que componen la atmósfera, se sostiene la
vida del planeta en sus diferentes niveles, porque no solo permiten nuestra
existencia sino la presencia de agua líquida en el mismo.
Podemos
decir que la presión atmosférica regula o controla la evaporación de los
fluidos dependiendo de sus propiedades y condiciones ambientales:
Incluso actividades como beber de un
pitillo o papote son posibles gracias a la presión atmosférica:
El
primer experimento de medición de la medida de la presión atmosférica fue
realizado por el Monje Torricelli usando mercurio y un tubo ensayo, de la
siguiente forma:
La
presión atmosférica varía según la altura sobre el nivel del mar, a mayor
altura, menor es la presión atmosférica.
Este
comportamiento lo podemos ver en otras actividades:
1.6.5.2.
PRESIONES DE VACÍO
Son presiones con valores inferiores a la
presión atmosférica, tiene muchas unidades las más comunes son las pulgadas de
mercurio, centímetros de mercurio, bares negativos, psi negativos y los
micrones de mercurio.
Ver
video:
|
DIFERENCIA
ENTRE PRESION MANOMETRICA Y PRESION ABSOLUTA |
|
1.6.5.3.
PRESION ABSOLUTA
Es la presión que se muestra teniendo en
cuenta la presión atmosférica y la manométrica, también se puede interpretar
como la presión medida partiendo del vacío absoluto.
PRESION ABSOLUTA =
PRESION ATMOSFERICA + PRESION MANOMETRICA
1.6.5.4.
PRESION MANOMETRICA
Es la presión ejercida por el fluido en sí
sin tener en cuenta la presión atmosférica. El instrumento que sirve para
medirla, se denomina Manómetro. Un manómetro se caracteriza principalmente
porque su medida comienza de cero a presión atmosférica
|
Fig 1.
Manómetro de refrigeración. |
PRESION
MANOMETRICA = PRESION ABSOLUTA – PRESION ATMOSFERICA
Un manómetro mide la diferencia entre la
presión medida y la atmosférica en el sitio. Un manómetro empleado en refrigeración
también posee las unidades de vacío o presiones menores que la atmosférica
medida ya sea en pulgadas de mercurio o en centímetros de mercurio.
Vemos
este ejemplo:
|
CONCEPTO DE
PRESIÓN Y SU IMPORTANCIA EN LA REFRIGERACION |
|
1.6.6.
FLUJO DE MASA O MASICO (
)
Es
la cantidad de masa de un fluido que pasa por un conducto por unidad de tiempo.
Sus unidades comunes son: Lbm/seg; Kgm/Seg
1.6.7.
ECUACION
DE ESTADO DE LOS GASES Y LEYES DE LOS GASES.
|
P V = m R T R = Ř / M
Ř = 1,986 Ř = 847,7 Ř = 1,986 Ř = 1545 (Ř = 10,73
|
Donde:
R: Constante
para un gas en particular.
M: Peso
molecular del gas en Kgm/Kmol o KLb/Kmol
Ř: Constante
universal de los gases.
T:
Temperatura en grados absolutos.
m: Masa del
gas. P: Presión
del gas absoluta. V: Volumen
del gas |
De lo anterior, se deduce que para dos estados
en el tiempo de un gas se tiene que:
PINICIAL VINICIAL =
m R TINICIAL y PFINAL VFINAL =
m R TFINAL
Como m*R es una constante en ambas
situaciones, se pueden igualar las mismas con el siguiente resultado:
{ (
PINICIAL VINICIAL )/ TINICIAL } = { ( PFINAL
VFINAL )/ TFINAL }
Uno de los aspectos más importantes de la
ecuación de estado radica en la relación directa que tiene la presión con la
temperatura y el volumen del mismo gas:
·
A
mayor presión, el gas contenido en un recipiente experimenta un aumento en su
temperatura.
·
A
menor presión, el gas contenido en un recipiente experimenta una disminución en
su temperatura.
Ahora si se comprime el gas del
recipiente:
Al de entrar de lleno en la ecuación de
estado, hay que recordar algunas leyes como:
·
Ley de Avogadro: Indica o
relaciona que, si se mantiene constante la presión y la temperatura de la
sustancia, el volumen ocupado por la sustancia es directamente proporcional el
número de moles o moléculas n del gas.
·
Ley de Dalton o
presiones parciales:
Indica o relaciona que si hay dos o mas gases dentro de un recipiente, la
presión total de la mezcla de gases es la suma de las presiones individuales de
cada gas componente de la mezcla.
Presion total de
la sustancia = Presión gas 1 + Presión gas 2 + …+ Presión gas n
·
Ley de Charles: Expresa que si
se mantiene la presión de un gas constante, y se le adiciona calor, este
aumenta su volumen y temperatura; si se le quita calor, el gas disminuye su
temperatura y volumen. en otras palabras, a presión constante el volumen de la
sustancia es directamente proporcional a la temperatura de la misma
( VINICIAL/TINICIAL
) = ( VFINAL/TFINAL )
( VINICIAL*TFINAL
) = ( VFINAL*TINICIAL )
Por otro lado,
si:
·
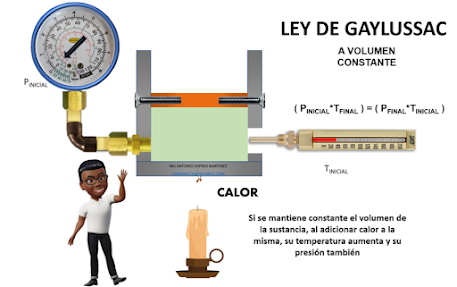
Ley de Gay Lussac: Expresa que si
se mantiene un volumen constante de una sustancia, y se le adiciona calor, aumenta la
temperatura y aumenta su presión; si se le quita calor, el gas disminuye su
presión en otras palabras, a volumen constante la presión de la sustancia es
directamente proporcional a la temperatura de la misma.
( PINICIAL/TINICIAL
) = ( PFINAL/TFINAL )
( PINICIAL*TFINAL
) = ( PFINAL*TINICIAL )
Por
otro lado, si:
·
Ley de Boyle: Expresa que si
se mantiene la temperatura de un gas constante, si se aumenta su volumen, este
disminuye su presión y viceversa.
PINICIAL*VINICIAL
= PFINAL*VFINAL
Por otro lado, si:
·
Ley Combinada de
los gases:
Establece la relación entre la presión ( P ) , la temperatura ( T ) y el
volumen ( V ) de la masa fija de un gas.
Al variar ya sea la temperatura, la
presión o el volumen, se tiene otra condición:
Ver video:
LEYES DE LOS GASES Y SU APLICACION EN LA REFRIGERACION Y CLIMATIZACION
1.7.
EL
ASUNTO DE LA REFRIGERACION
Como lo que se desea en la refrigeración es la
disminución o reducción de la temperatura de un cuerpo o sustancia, ya se sabe
que, si un cuerpo pierde calor, entonces su temperatura disminuye e inclusive
puede cambiar a un estado de la materia donde sus moléculas estén más unidas;
si un cuerpo gana calor, entonces experimenta un aumento de su temperatura o
puede cambiar a un estado de la materia donde sus moléculas estén más
separadas.
Para reducir la temperatura de la sustancia,
recordemos la ley de GAY LUSSAC:
Recordemos que los fluidos al incrementar su velocidad pierden presión y éste el principio de vuelo de los aviones.
En conclusión:
Para incrementar la velocidad de un fluido,
Analicemos cuando un fluido pasa por un conducto que cambia de sección o
tamaño.
Por tanto:
Con relación a las pérdidas de rozamiento:
OBS: La anterior ecuación depende mucho del
estado de turbulencia del fluido que se determina con el número de Reynolds.
Ver video:
COMO ES EL PROCESO PARA REFRIGERAR UNA SUSTANCIA O CUERPO
La variación de la temperatura en un recinto
depende del equilibrio de la siguiente ecuación:
CALOR ENTRA + CALOR GENERADO = CALOR SALE
Donde:
Analicemos las siguientes situaciones cuando:
CALOR ENTRA + CALOR GENERADO < CALOR SALE
Analicemos las siguientes situaciones cuando:
CALOR ENTRA + CALOR GENERADO > CALOR SALE
Para seguir reduciendo la temperatura del
recinto, se tienen tres opciones:
Ver video:
EQUILIBRIO DE CALOR EN UN RECINTO
1.8. DIAGRAMAS PRESION – ENTALPIA Y TEMPERATURA – ENTROPIA
En
refrigeración generalmente se manejan dos variables, la temperatura y la
presión. Con ambas propiedades se construyen dos diagramas:
1.8.1.
ORIGENES DE LOS DIAGRAMAS DE MOLLIER
Los
diagramas de los análisis de las sustancias son gráficos 3D tal cual como se
observa:
Los
gráficos vienen de las diferentes proyecciones de las caras en sistema 2d, tal
como se muestra:
Veamos a continuación el diagrama de
fases:
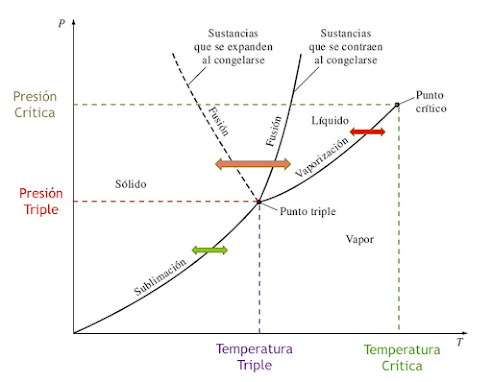
En este diagrama se observan los limites
de los tres estados y los procesos de cambio de estado con base en las
presiones y los valores de temperatura. En este grafico se identifican dos
puntos en especial:
·
El
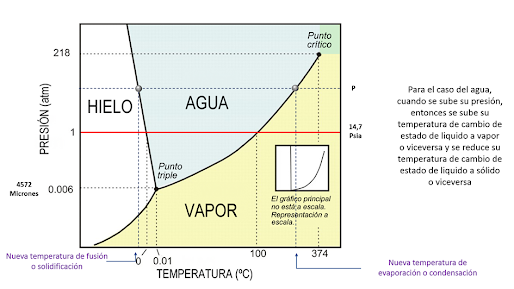
punto crítico: Es el punto que se da a altas presiones y altas temperaturas,
donde es difícil distinguir la diferencia entre el estado liquido y el estado
vapor.
·
El
punto triple: Es el punto en donde dadas unas condiciones de baja presión y
temperatura, conviven en equilibrio los tres ( 3 ) estados.
El análisis especial está, en las
condiciones del punto critico, en el cual podemos identificar tres condiciones:
·
El
fluido supercrítico cumple con dos condiciones: su temperatura esta por encima
de la temperatura critica y su presión esta por encima de la presión critica.
·
Liquido
especial tiene temperaturas menores a la temperatura critica, pero presiones
mayores a la presión critica.
·
Vapor
especial tiene presiones menores de la presión crítica, pero temperaturas
mayores de la temperatura critica
En
relación al diagrama de presión versus volumen se tiene:
· En
el diagrama están los tres estados y sus zonas.
·
Los
limites entre los estados se identifican por líneas y se denomina saturadas. Se
pueden observar las líneas de liquido saturado, vapor saturado y solido
saturado.
A continuación, vamos a realizar el
análisis del comportamiento de las sustancias cuando están sometidas a
presiones menores que la presión crítica; en estas condiciones se concluye que:
·
Es
posible condensar o evaporar isotérmicamente.
·
Es
posible condensar o evaporar isobáricamente.
·
Se
distinguen fácilmente los estados.
·
Hay
diferencias entre el volumen que posee el estado liquido y el volumen que posee
el estado vapor.
Ahora, las condiciones por encima del
punto crítico son diferentes, entre los cuales podemos concluir:
·
No
es posible condensar o evaporar isotérmicamente por encima de la temperatura
critica
·
No
es posible condensar o evaporar isobáricamente por encima de la presión
critica.
·
No
se distinguen fácilmente los estados.
·
No
hay diferencias entre el volumen que posee el estado liquido y el volumen que
posee el estado vapor.
Por lo expresado anteriormente, podemos
dividir el diagrama en zonas, tal como se muestra:
Ver video:
ANALISIS DEL ORIGEN DE DIAGRAMAS DE FASES Y DE MOLLIER DE LAS SUSTANCIAS APLICADOS A REFRIGERACION
1.8.2.
GENERALIDADES
DEL PUNTO TRIPLE.
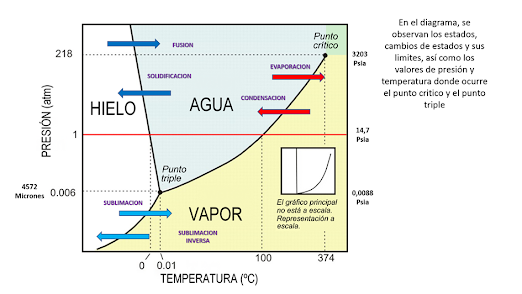
El punto triple de las sustancias es un
punto muy especial porque coexisten los tres estados en equilibrio: el líquido,
el gaseoso y el sólido. Ocurre a bajas temperaturas y bajas presiones. Se
analiza a partir del diagrama de fases.
En este diagrama se pueden observar las
fronteras de los cambios de estados, para el caso tomemos el ejemplo del agua:
En
el diagrama a partir del valor de presión, se obtienen por consiguiente las
temperaturas a las cuales esa sustancia cambia de estado , tal como se observa:
Analicemos ahora lo que pasa con las
temperaturas de fusión o solidificación así como la de condensación o
evaporación cuando se sube o reduce la presión de la sustancias, en este caso,
el agua:
Analicemos ahora lo que pasa cuando se
modifican la temperatura de la sustancia a manteniendo la presión constante:
En el caso de partir en el estado sólido:
Ver
video:
|
|
|
1.8.3.
DIAGRAMA TEMPERATURA Vs ENTROPIA ESPECIFICA
La entropía ( S ) es una medida de la
irreversibilidad de los procesos que se realizan; un proceso es isoentrópico en
la medida que es un proceso perfecto sin perdidas o sea, un proceso ideal done
el SINICIAL es igual al SFINAL . Las unidades de entropía
es el BTU, pero generalmente se trabaja con el valor de la entropía específica
( s ) cuyas unidades son BTU/Lbm ºR.
s = S / m 1
BTU/Lbm ºR = 1 Kcal/Kgm º K
Para una sustancia cualquiera se construye
el diagrama T Vs S ubicando en el eje vertical se ubican los datos de
temperatura y en el eje horizontal los valores de entropía S o de entropía
específica s. La campana divide la fase de la sustancia en Liquida, Mezcla o la
zona donde ocurre el cambio de fase y la fase gaseosa o de vapor.
En relación a las líneas de temperatura
constante ( ISOTERMAS ), presión contante ( ISOBARICAS ), volumen especifico
constante ( ISOCORICAS ), entropías constantes ( ISOENTROPICAS ) y entropías
específicas constantes ( ISOENTROPICAS ), se pueden observar en las siguientes
figuras:
Las curvas de presiones absolutas van en
ascenso a medida que nos subimos en el diagrama y en descenso a medida que nos
bajamos en el diagrama. Para cada presión absoluta se tiene una temperatura de
saturación que es la temperatura a la que ocurre un cambio de estado, ya sea el
proceso de evaporación o de condensación a temperatura constante a la presión
indicada ( en los procesos de cambio de estado, la temperatura se mantiene
constante ).
El valor de dicha temperatura se puede
hallar en las tablas del vapor saturado de la sustancia, en las tablas del
vapor recalentado de la sustancia o en los manómetros que miden las diferentes
presiones. De acuerdo con lo expresado anteriormente una sustancia puede tener
5 condiciones:
Punto A: Se está en la zona de liquido a
una presión atmosférica de 1 Bar. La temperatura del punto a por ser menor que
la temperatura de saturación a la presión dada, se le denomina LIQUIDO
SUBENFRIADO.
Punto B: Se está en la línea del líquido
saturado a la temperatura de saturación para la misma presión, por tanto se le
denomina LIQUIDO SATURADO. En este punto cualquier adición de calor , la
sustancia experimenta un cambio de fase ( evaporación ).
Punto C: Se está en pleno cambio de fase a
la temperatura de saturación para la presión dada. El factor característico de
un cambio de fase es que la temperatura se mantiene constante. Cuando existe una sustancia en
donde una parte de ella está en forma líquida y la otra en forma de vapor, como
en este punto, se define su CALIDAD como la porción de masa de vapor a la masa
total de la sustancia. La calidad sólo existe en cambio de fase.
|
CALIDAD ( X ) = ( Mv / Ms )*100% |
Donde: Mv: Masa vapor Ms: Masa total sustancia Masa total sustancia = Masa Vapor + Masa
Liquido |
Punto D: Se ha completado el cambio de
fase y se está en la línea del vapor saturado, por tanto, se le denomina VAPOR
SATURADO. En este punto cualquier eliminación de calor, la sustancia
experimentara un cambio de fase ( condensación ).
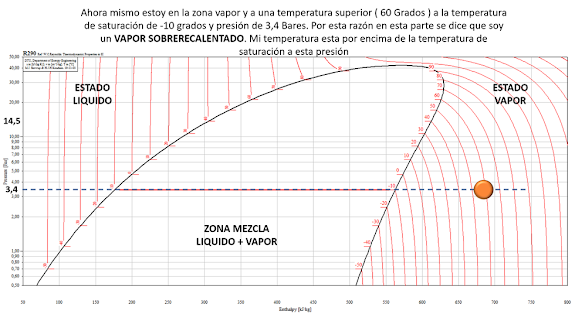
Punto E: Se está en la zona de vapor pero
a una temperatura mayor que la de saturación, por tanto se le denomina VAPOR SOBRECALENTADO.
Calor latente: Se da del punto B al D.
Calor sensible: Se da del punto A al B y
del D al E.
En el diagrama se puede observar el PUNTO
CRITICO, es el punto en el cual a dicha presión la sustancia se vuelve
inestable y por lo general no se recomienda trabajar bajo estas condiciones.
Del diagrama se pueden obtener las
siguientes conclusiones:
·
A
mayor presión del fluido, mayor será la temperatura a la que cambia fase ( temperatura de saturación ).
·
A
menor presión del fluido, menor será la temperatura a la que cambia fase ( temperatura de saturación ).
·
La
temperatura de condensación es la misma de evaporación a la presión dada.
·
Si
hay miles de presiones miles de temperaturas de cambio de fases existirán.
Ver video:
GENERALIDADES DEL DIAGRAMA TEMPERATURA VS ENTROPIA EN TERMODINAMICA
1.8.4.
DIAGRAMA PRESION Vs ENTALPIA ESPECIFICA
La entalpía ( H ) es una medida de la
cantidad de calor que tiene almacenada una sustancia de acuerdo a una
temperatura y a una presión absoluta dada. Las unidades de entalpía es el BTU,
pero generalmente se trabaja con el valor de la entalpía específica ( h ) cuyas
unidades son BTU/Lbm.
h = H / m 1
BTU/Lbm = 1.8 Kcal/Kgm = 7,5348 KJ/Kgm
El diagrama Presión entalpía es similar al
de temperatura entropía, tiene las mismas zonas de fases, las mismas líneas de
saturación pero ahora se trabaja con las variable de presión y entalpía específica.
Las líneas de presión o ISOBARAS son ahora
completamente horizontales y no hay forma de ubicar temperaturas por eso se
recomienda el uso de ambos diagramas para una mejor ubicación de los procesos.
Con relación a las líneas ISOENTALPICAS o
de entalpias específicas constantes, se construyen en forma vertical, tal como
se muestra:
Con relación con las líneas o curvas de
volumen específico constante, se tienen:
Con relación a las líneas de temperatura ISOTERMAS o
ISOTERMICAS, tienen una construcción diferente al diagrama T Vs s, de la
siguiente forma:
Con relación a las líneas de calidad ( X )
, estas solo están en la zona de mezcla del diagrama y determinan el porcentaje
de vapor de la mezcla; se pueden expresar en porcentaje.
Ahora nos referimos a las líneas de
Entropía Específica o de irreversibilidad en el diagrama:
Recordando que la temperatura de
saturación es la temperatura a la que ocurre un cambio de estado dependiendo
del valor de presión, en el diagrama ambas curvas se superponen en la zona de
mezcla, tal como se muestra:
La temperatura de saturación o de cambio
de estado es proporcional a la presión, o sea, a mayor presión, mayor
temperatura de saturación y viceversa:
Los estados de las sustancias en el
diagrama, dependiendo de su presión, temperatura y estado, se les asignan
nombres, entre los cuales se tienen:
Para ubicar un punto en las zonas de líquido
subenfriado o vapor sobrecalentado, solo se necesitan saber o conocer dos
valores o parámetros, los más comunes son la presión y la temperatura:
Para ubicar un punto en las zonas de mezcla,
se necesitan saber o conocer de un tercer valor o parámetro, el más común es la
Calidad ( X ):
Tengamos en cuenta que:
·
En
los procesos de cambio de estado de liquido a vapor ( evaporación ) es donde las
sustancias piden o requieren altas cantidades de energía calorífica.
·
En
los procesos de cambio de estado de vapor a líquido ( condensación ) es donde las
sustancias pierden o retiran altas cantidades de energía calorífica.
NOTA: Cuando desee calcular los valores de
v, u, s o h dentro de la zona de mezcla, aplique las siguientes ecuaciones:
u
= uf + ( X
* ufg )/100%
h
= hf + ( X
* hfg )/100%
s
= sf + ( X
* sfg )/100%
Donde
X es la calidad en porcentaje.
Ver videos:
GENERALIDADES DEL DIAGRAMA DE MOLLIER PRESION VS ENTALPIA ESPECIFICA
INTRODUCCION A LOS DIAGRAMAS DE MOLLIER APLICADOS EN REFRIGERACION
1.8.5.
EL CONCEPTO DE LA TEMPERATURA DE SATURACION
Es la temperatura a la cual, ocurre el cambio de estado a una presión establecida o dada; también se puede definir como la temperatura que divide a los dos estados a una presión dada. Primeramente, recordemos las zonas de un diagrama P vs h.
A continuación, se van a analizar varias
situaciones donde se va a comenzar con una situación con un punto A donde se
tiene un estado líquido a baja temperatura ( aproximadamente – 44 grados
Celsius ):
Si a esta sustancia se le adiciona calor, el
punto A se desplaza hacia la derecha hasta llegar al punto de líquido saturado
( punto B), donde está a punto de cambiar del estado líquido al estado vapor a mayor
temperatura ( aproximadamente – 10 grados Celsius )
Si se sigue añadiendo calor, la sustancia
cambia de estado a presión constante y a temperatura constante hasta llegar al
estado valor en el punto D.
Estando la sustancia en estado vapor, si
se sigue la adición de calor a presión constante, ésta incrementa su temperatura
hasta llegar a un punto E a igual presión pero con mayor temperatura (
aproximadamente 60 grados Celsius ) , tal como se muestra:
Tenga en cuenta que tanto la línea de
presión constate o Isóbara y la línea de temperatura constante o Isoterma, se superponen
en la zona de mezcla o dentro de la campana del diagrama de Mollier.
Por otro lado, la temperatura de
saturación o de cambio de estado posee una relación directa con la presión, o
sea, a mayor presión, mayor será la temperatura de saturación o de cambio de
estado y viceversa.
Con esta propiedad también se puede
determinar la temperatura a la cual el refrigerante cambia de estado
dependiendo de una presión dada; por ejemplo, si poseemos un tanque de
refrigerante R-22 con una presión de 158 Psig, acudiendo a la tabla de
presión-temperatura, su temperatura de saturación es de 30ºC.
Ahora, la temperatura de saturación, la de
evaporación y la de condensación los las mismas, y su diferencia está en el
sentido del proceso:
Ver video:
LA TEMPERATURA DE SATURACION EN LA REFRIGERACION
1.6.
FUNDAMENTOS
DE LA MECANICA DE FLUIDOS APLICADOS A REFRIGERACION Y CLIMATIZACION
La mecánica de fluidos es una de las ciencias
cuyos fundamentos son principio de muchos procesos de la refrigeración, los
cuales podemos comprender si comprendemos estos principios, ecuaciones y lees
entre la cuales se tienen:
1.9.1.
ECUACION
DE CONTINUIDAD DE FLUJO
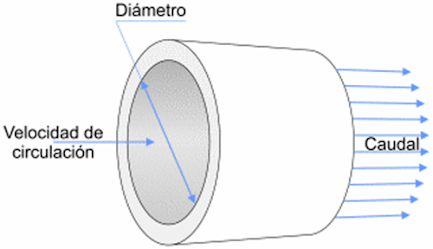
Analicemos cuando un fluido pasa por un conducto
que cambia de sección o tamaño. El volumen que entra al tubo en la sección 1,
es el mismo que sale por la sección 2
Si el volumen
que entra al tubo en la sección 1, es el mismo que sale por la sección 2,
entonces se cumple lo mismo para el caudal o flujo volumétrico ( Q ).
Realicemos el
análisis de las velocidades del fluido en ambas secciones del tubo:
En conclusión, cuando el fluido pasa de un
tubo con mayor sección o diámetro a uno de menor sección o menor diámetro,
experimenta un aumento de su velocidad.
1.9.2.
ECUACION
DE BERNOULLY
Analicemos cuando un fluido pasa por un conducto
que cambia de sección o tamaño, donde se establece que la energía de un fluido
ideal que circula por un conducto se mantiene constante.
Energía Potencial + Energía Cinética + Energía del flujo = Constante
Ahora vamos a añadirle unas pérdidas, y
por tanto la ecuación que de la siguiente forma:
( m g Z1 ) + ( mV12 /2 ) + ( P1m/ρ
)= ( m g Z2 ) + ( mV22 /2 ) + ( P2m/ρ
) + Pérdidas
Donde Z es la posición
del fluido, m la masa del fluido, V la velocidad el fluido, g la gravedad, P la
presión de fluido y ρ la densidad del fluido.
Despreciando el cambio de energía
potencial y teniendo en cuenta que es el mismo fluido sin cambios de densidad
se tiene que:
En conclusión:
•
A
mayor diferencia entre los diámetros de los tubos, mayor será la velocidad del
fluido en el tubo de menor diámetro y viceversa.
( Diam12/Diam22
)* Velocidad 1= Velocidad 2
•
A
mayor diferencia de velocidad entre los fluidos, mayor será la diferencia de
presión entre los mismos.
( P1 – P2)/ρg
= ( V22 - V12 )/2g
+ Pérdidas
•
Por
tanto, a mayor diferencia entre los diámetros de los tubos, mayor será el
diferencial de presión entre ambas secciones.
Estas ecuaciones se aplican no solo para
el diseño de tuberías sino para el diseño de elementos de expansión como capilares
y orificios:
Ver video:
LA ECUACION DE CONTINUIDAD DE FLUJOS Y BERNOULLY EN EL PRINCIPIO OPERACION DE ORIFICIOS Y CAPILARES
FIN













































































































































































































No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.